
핵산치료제, 화학합성으로 코스트 낮아 “강점”
최근에는 유전정보가 DNA→RNA→단백질 순으로 전사·번역된다는 분자생물학 개념인 센트럴도그마(Central Dogma)에 개입하는 의약품이 증가하고 있다.
핵산치료제인 미국 바이오젠(Biogen)의 스핀라자(Spinraza), 앨라일람(Alnylam Pharmaceuticals)의 온패트로(Onpattro) 등으로 저분자의약품, 항체의약품을 잇는 치료제로 주목받고 있다.
핵산치료제는 유전자를 표적으로 공격할 수 있고 유전자치료제와 달리 비용이 저렴한 화학합성 프로세스로 제조할 수 있는 특징이 있다.
척수성 근위축증(SMA)은 운동뉴런을 보조하는 단백질 SMN이 정상적으로 생성되지 않아 발생하는 질환으로, DNA에서 RNA로 정보가 전달되는 스플라이싱(Splicing) 과정에서 본래 필요한 유전자 영역(엑손)의 7번째가 제거되는 것이 원인인 것으로 파악되고 있다.

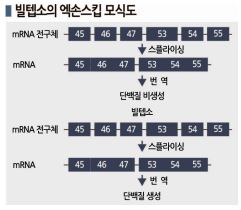
스핀라자는 제거를 방지하도록 엑손7에 결합함으로써 SMN을 생성해 SMA를 치료하는 의약품으로 엑손 인클루전(Exon Inclusion) 기술을 채용하고 있다.
유전성 희귀질환인 TTR형 가족성 선종성 용종증(FAP) 치료제 온패트로는 RNA 간섭현상을 이용해 DNA로부터 유전자 정보를 받는 RNA를 절단한다.
 FAP는 TTR 단백질이 섬유화해 매우 많은 장기부전을 일으키는 질환으로 RNA 간섭에 따라 TTR 생성을 절단할 수 있는 것으로 알려졌다.
FAP는 TTR 단백질이 섬유화해 매우 많은 장기부전을 일으키는 질환으로 RNA 간섭에 따라 TTR 생성을 절단할 수 있는 것으로 알려졌다.
일본 Nippon Shinyaku가 개발한 빌텝소(Viltepso)는 스핀라자와 마찬가지로 스플라이싱에 관여하는 의약품으로 스플라이싱 과정에서 엑손53을 제거(스킵)함으로써 단백질 생산을 촉진하는 것으로 파악되고 있다.
스플라이싱 제어와 RNA 간섭은 RNA에 작용하는 공통점이 있는 반면, 저분자의약품과 항체의약품은 RNA가 아닌 단백질을 타깃으로 삼고 있다.
핵산치료제는 유전자 본체인 RNA를 겨냥할 수 있어 질환의 원인 분자를 근원부터 배제할 수 있는 특징이 있다.
아울러 항체와 같은 세포 배양이 아닌 화학합성으로 제조할 수 있으며 약효가 증명되면 유사한 질환에도 응용할 수 있는 것으로 파악되고 있다.
다만, 핵산은 체내에서 쉽게 분해됨에 따라 표적부위에 안정적으로 도달하는 약물전달(Drug Delivery) 기술이 실용화를 좌우할 것으로 예상되고 있다.
일본에서는 Nippon Shinyaku에 이어 다케다(Takeda Pharmaceutical), 다이이찌산쿄(Daiichi Sankyo), 시오노기(Shionogi)가 개발에 나서고 있으며 도레이(Toray), 스미토모케미칼(Sumitomo Chemical)도 신약 개발 벤처 보나쿠(Bonakku)와 함께 시장 진입을 추진하고 있다.
유전자치료제, 양산기술 확립이 관건…
단백질 설계도로도 불리는 유전자는 다양한 단백질의 체내 생성 여부를 결정한다.
유전자치료제는 원하는 단백질에 대응하는 유전자를 외부에서 투입하면 된다는 개념으로 개발이 이루어지고 있다.
혈우병은 선천적으로 혈액 응고인자를 만드는 능력이 없어 발생하는 질환으로 인공적인 응고인자제제를 주입하는 방법이 표준치료법으로 자리 잡고 있다.
그러나 일본 다케다, 미국 화이자(Pfizer)는 환자에게 응고인자를 생성하는 유전자가 있으면 해결되는 문제라는 인식 아래 유전자치료제를 개발하고 있다.
스위스 노바티스(Novartis)가 개발한 SMA 치료제 졸겐스마(Zolgensma)도 비슷한 구조로 파악되고 있다.
SMA는 운동뉴런을 돕는 단백질 SMN이 생성되지 않아 신체장애가 발생하는 질환으로 졸겐스마는 SMN을 생성하는 유전자를 포함하고 있다.
환자에게 유전자를 투여하는 방식은 오래전부터 시도됐고 1990년에는 미국에서 최초로 임상시험이 이루어졌으나 이후 환자가 사망하는 사고가 발생해 암흑기에 들어섰다. 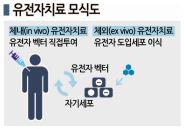
사고원인은 유전자 운반체인 벡터로 파악되고 있다. 당시에는 유전자를 표적세포에 전달하는 벡터로 바이러스가 주목받았다.
바이러스는 유전자 본체인 DNA 및 RNA를 단백질 껍질인 캡시드(Capsid)가 둘러싸고 있는 구조를 형성하고 있어 감염증 유행을 통해 확인할 수 있는 바와 같이 인체에 대한 침입능력이 높은 특징이 있다.
이에 따라 이론상으로는 무해한 바이러스를 만들어 벡터로 사용함으로써 유전자를 자유롭게 투입할 수 있을 것으로 판단됐으나 바이러스 벡터를 안전하고 효율적으로 만들기가 어려웠다.
과거 발생한 사망사고는 바이러스 벡터에 대한 이상 면역반응에 따른 것으로, 당시에 비해 기술이 향상됐음에도 벡터 개발과 관련해서는 시행착오가 계속되고 있다.
일본 아스테라스제약(Astellas Pharma)은 2019년 말 유전자치료 분야의 선도기업으로 도약하겠다는 목표를 세우고 3000억엔 이상을 투입해 미국 오덴테스테라퓨틱스(Audentes Therapeutics)를 인수했다.
오덴테스는 아데노 수반 바이러스(AAV) 벡터에 강점을 보유하고 있으며 직접 생산설비도 가동하고 있어 인수를 결정한 것으로 알려졌다.
 벡터 연구는 AAV가 주류를 이루고 있다.
벡터 연구는 AAV가 주류를 이루고 있다.
AAV는 주입한 유전자가 장기간 발현하는 특징이 있으며, 졸겐스마는 정기적인 투여가 필요한 핵산치료제 스핀라자와 달리 1회만 투여해도 평생 SMN이 생성되는 것으로 파악되고 있다. 그러나 실제 1회 투여만으로 완치되는지는 아직 확실하게 밝혀지지 않았다.
아울러 유전자치료제는 제조비용에 따라 가격이 매우 높은 수준을 형성하고 있어 수작업에서 벗어나 효율적인 양산체제 구축이 요구되고 있다.
광관련요법, 신규 치료법으로 개발 가속화
최근에는 수술, 방사선, 화학, 면역을 잇는 새로운 치료법으로 빛에 대한 관심이 높아지고 있다.
광역학요법(PDT), 광면역요법(PIT) 등이 있으며 종양조직과 결합하는 화합물에 레이저광을 조사해 암세포만 파괴하는 방식으로 정상세포에 영향을 주지 않아 환자 부담을 경감할 수 있는 특징이 있다.
PDT는 메이지세이카(Meiji Seika Pharma)가 사업화하고 있다.
종양 친화적인 광감수성을 보유한 약제를 투여한 후 레이저를 조사함에 따라 광화학 반응을 일으켜 암세포를 변성·괴사하는 것으로 수술에 비해 침습성이 낮은 이점이 있다.
메이지세이카는 교토(Kyoto)대학 등으로부터 의사 주도 임상시험 결과를 받아 승인을 취득했다.
2016년에는 파나소닉헬스케어(Panasonic Healthcare)의 PDT 장치 사업을 인수해 치료에 이용하는 약제와 의료기기 공급체제를 모두 확보했다.
적응증은 초기 폐암, 원발성 악성 뇌종양, 재발 식도암으로 앞으로는 다양한 임상실적을 바탕으로 적용범위를 확대할 방침이다.
미국 국립암연구소(NCI)의 고바야시 히사타카 주임연구원이 개발한 PIT는 라쿠텐메디컬(Rakuten Medical)이 개발 및 상업화 권리를 취득해 실용화를 추진하고 있다.
일본에서는 2019년 7월 의약품 제조판매업 및 의료기기 제조판매업에 대한 허가를 얻었다.
PIT는 암세포에 도달하는 항체복합체를 표적으로 레이저광을 조사해 환부만 치유할 수 있는 특징이 있으며 두경부암과 식도암을 대상으로 개발을 진행하고 있다.
나고야(Nagoya) 대학 연구그룹은 소세포폐암에 대한 전임상시험을 실시해 효과를 확인한 것으로 알려졌다.
라쿠텐메디컬은 앞으로 PIT 연구개발(R&D)을 계속함과 동시에 글로벌화를 위한 서플라이 체인 구축에 힘을 기울일 방침이다. (강윤화 선임기자: kyh@chemlocus.com)























