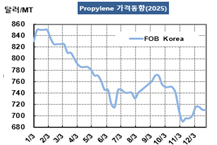
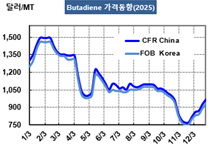
Merck, HPV 예방백신 시장 선점
|
GSK는 2008년 FDA 출원 가능 … 세계 시장규모 10억-30억달러 선 Merck가 GSK(GlaxoSmithKline)를 제치고 HPV 예방백신 시장을 선점할 것으로 예상된다.Merck는 세계 최초로 유두종 바이러스(HPV: Human Papillomavirus) 예방백신을 개발해 미국시장에 출시하고 GSK 또한 거의 같은 시기에 HPV 백신을 유럽시장에 선보일 것으로 알려졌다. 전문가들은 HPV 발병가능 인구가 수백만에 달한다는 점을 들어 HPV 백신 시장규모가 수십억 달러대에 이를 것으로 전망하고 있다. Merck는 최근 자사의 HPV 백신제품인 Gardasil의 성공적인 임상실험 결과를 발표하며 선두주자로서의 입지 강화에 나섰다. 미국, 유럽, 브라질 출신 여성 522명을 대상으로 한 2단계 실험에서 잠복기가 긴 HPV 감염 및 관련질환 발병률을 현저히 낮추는 효능이 입증됐는데 Gardasil 투약을 받은 환자들은 2년6개월 후 플라시보(Placebo) 치료만을 받은 환자들보다 HPV 감염률이 90% 낮게 나타난 것으로 알려졌다. 백신의 효능과 용도를 평가하기 위한 실험은 것은 아니었으나 HPV 타입 16, 18, 6, 11이 일으키는 경부전암(Cervical Precancer) 예방효과가 100%에 달한 것으로 나타났다. Gardasil에 대한 3단계 실험은 현재 진행중으로 결과는 2005년 하반기에 발표될 예정이다. Merck은 또 2005년 하반기에 FDA(Food & Drug Administration)에 기술인가 등록을 마칠 방침이고 출시는 2006년 이루어질 것으로 예상된다. Merck의 백신은 경부암(Cervical Cancer)과 생식기 혹(Genital Wart)을 발병시키는 HPV 타입 6, 11, 16, 18 예방용으로 기술인가 출원시 9-24세 환자들에 대한 임상실험 결과를 제출할 방침이다. 반면, GSK가 개발한 Cervarix는 HPV 16, 18 예방용으로 암 백신으로 출시될 가능성이 높은 것으로 알려졌는데 2차 임상실험에서 플라시보 치료만을 받은 355명의 여성환자 중 13명이 HPV 바이러스에 감염된 반면 투약을 받은 여성환자는 366명 모두 HPV에 감염되지 않은 것으로 나타났다. GSK는 3차 임상실험을 진행중이며 2006년 EU에 Cervarix 출원을 신청할 계획이지만 FDA 출원은 2008년에나 가능할 것으로 예상돼 Merck보다 미국시장 진출이 2년가량 늦어질 것으로 파악되고 있다. HPV 백신 시장은 미국에서만 환자수가 550만명에 달하고 절반가량은 악성 HPV 타입인 것으로 조사되고 있고 세계적으로 경부암 환자가 매년 50만명씩 생기는 것으로 추정돼 시장 진출시점이 매우 중요한 것으로 판단되고 있다. 현재 HPV 처방은 매우 제한적이어서 HPV가 아닌 다른 바이러스 치료용 약품이 대부분이고 생식기 혹 제거 수술은 환자의 진통이 심하다. HPV 예방백신의 주 수요층은 정기적으로 예방접종을 받아야 하는 12세 이하 어린이, 12-15세 청소년, HPV 면역력이 없는 성인 여성 등 3그룹으로 알려지고 있다. 그러나 HPV 예방백신을 면역치료용(Immunization Regimen)으로 사용하기에는 다소 어려움이 따르는데 청소년들은 성적으로 감염되는 질환에 대한 면역력을 인위적으로 부과해야 한다는 도덕적 딜레마가 따르기 때문이다. 문제점을 피해가기 위한 한 가지 방법이 HPV 백신을 성관련 질환 치료제가 아닌 암 치료용으로 마케팅하는 것이지만 HPV와 경부암이 서로 밀접한 관련이 있다는 인식을 대중들에게 심어주지 못하게 될 수 있는 것으로 지적되고 있다. 한계에도 불구하고 Datamonitor는 Merck과 GSK가 개발한 HPV 백신의 잠재수요가 10억-30억달러에 달하는 것으로 추정하고 있다. 이미 감염돼 있는 환자들에 대한 치료용 약품 또한 개발 중인데, MGI Pharma는 2004년 Zycos를 인수해 Zycos가 개발하고 있던 경부형성장애(Cervical Dysplasia) 및 생식기 혹 치료용인 ZYC101a 개발을 계속하고 있다. ZYC101a는 2단계 임상실험을 마치고 2005년 중반 3단계 실험에 돌입할 계획이다. Xenova Group은 면역 치료법인 TA-HPV 및 TA-CIN을 보유하고 있으나 출시제품의 우선순위 문제로 개발이 늦춰지고 있다. CRT(Cancer Research Technology)는 경부형성 장애 여성 환자를 대상으로 1, 2단계 임상실험을 마친 TA-CIN 사용권을 취득하고 이를 이용해 개발한 약품에 대한 2단계 임상실험을 진행할 예정이며 글로벌 상용화 사업파트너도 물색하고 있다. Epimmune과 Genencor 또한 치료용 HPV 백신을 임상실험을 진행하고 있다. HPV 관련 의약제품은 아직 개발 초기 단계이지만 환자수가 엄청나 시장 잠재력이 큰 것으로 지적되고 있다. <화학저널 2005/08/16> |
한줄의견
관련뉴스
| 제목 | 날짜 | 첨부 | 스크랩 |
|---|---|---|---|
| [제약] Merck, 박테리아에 유전자 편집 접목 | 2018-05-17 | ||
| [자동차소재] Merck, 자동차소재 사업 “혁신” | 2018-04-18 | ||
| [제약] Merck, 유전자치료 혁신 선도한다! | 2017-12-21 | ||
| [제약] Merck, 생명과학 정밀도 향상 기대 | 2017-12-12 | ||
| [에너지정책] Merck, 자동차에 OLED 소재 공급 | 2017-08-24 |