바이오기술은 농림수산업을 중심으로 건강·의료, 식품, 화학 등 다양한 산업에 활용되고 있다.
경제협력개발기구(OECD)가 2009년 발표한 보고서 The Bioeconomy to 2030에 따르면, OECD 회원국의 바이오 시장규모는 2030년 약 1조6000억달러에 달하는 가운데 공업이 39%, 농업이 36%, 건강이 25%를 차지할 것으로 예상되고 있다.
디지털 혁명은 모든 산업과 사회활동에 영향을 미치고 있다.
바이오산업도 유전자 재조합(GM) 기술이 등장함과 동시에 IoT(사물인터넷), AI(인공지능) 기술이 비약적으로 발전하면서 유전정보 등 빅데이터 활용이 가능해져 일대 혁신이 일어나고 있으며, 앞으로는 다양한 기술 혁신을 융합함으로써 잠재적인 생물기능을 이끌어낼 수 있을 것으로 판단되고 있다.
이에 따라 기능이 고도로 디자인된 생물세포인 스마트셀(Smart Cell) 산업 형성을 가속화하는 움직임이 나타나고 있으며 건강·의료 뿐만 아니라 공업, 농업, 에너지·환경 분야의 산업구조에 대대적인 변혁을 일으키면서 인류가 직면한 문제를 해결하는데 크게 기여할 것으로 예상되고 있다.
바이오인포매틱스, 생명현상 해명에 활용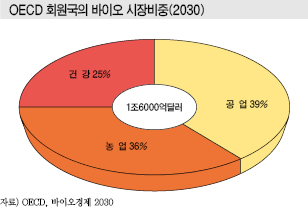
바이오인포매틱스(Bioinformatics)는 생명과학 연구의 진보를 이끌어 신약 개발 및 의료를 한층 높은 단계로 끌어올리고 있다.
최근에는 실제로 생명현상의 전체상을 이해하고 계층을 뛰어넘는 시스템으로 통합적인 파악이 가능한 시스템생물학(System Biology)이 응용되고 있다.
이에 따라 생명현상의 복잡한 계층구조, 다양한 효소의 상호작용을 해명하는데 필요한 정보량이 폭발적으로 늘어남으로써 컴퓨터를 이용한 수학적인 프로세스가 필수적으로 요구되고 있으며 기계학습을 비롯한 AI 도입도 시도되고 있다.
생명과학은 1990-2000년대 진행된 인간 게놈(Human Genome) 프로젝트를 거쳐 게노믹스(Genomics), 프로테오믹스(Proteomics), 메타볼로믹스(Metabolomics) 등으로 총체적 해석이 이루어졌으나 개별 계층에 한정된 연구로는 생명현상을 해명하기 어려운 한계에 부딪혔다.
이에 따라 최근에는 멀티오믹스(Multiomics)가 부상하고 있다.
생명현상은 여러 계층으로 분류된 다양한 인자가 복잡한 상호관계 속에 각기 네트워크 또는 흐름을 구축해 발현되기 때문에 게놈, 에피게놈(Epigenome), 유전자, 단백질, 대사물질 등 모든 인자를 시스템생명학에 따라 포괄적으로 파악할 것이 요구되고 있다.
전체상을 본다는 측면에서는 미개척 영역도 대상에 포함하는 것이 중요한 것으로 판단되고 있다.
암 연구에서는 최근 게놈 변이가 시스템 이상을 일으키는 메커니즘을 발견한 사례가 있다.
슈퍼컴퓨터를 이용한 바이오인포매틱스의 연구성과로 보고되는 것으로, 성인 T세포 백혈병 림프종(ALT) 환자 48명을 대상으로 유전자 이상을 총체적으로 해석한 결과 2857개에 달하는 구조 이상을 발견했으며 PD-L1 유전자 이상이 면역체계를 혼란시켜 암세포를 공격하지 않도록 막고 있다는 사실을 밝혀냈다.
특히, 단백질을 암호화하지 않은 인트론(Intro) 부위에서 이상현상이 발생해 주목받았다.
단백질을 암호화한 엑손(Exon) 부위를 대상으로 실시한 기존 유전자 연구에서는 발견되지 않았던 사실로, 슈퍼컴퓨터를 이용한 대규모 바이오인포매틱스의 유효성을 입증한 사례로 평가되고 있다.
그러나 전체적인 생명 시스템에 대한 연구는 최신 슈퍼컴퓨터로도 대응하기 어려운 것으로 파악되고 있다.
체내에 존재하는 단백질은 약 10만개로 2개의 상호작용만 계산해도 조합이 10만×10만에 달할 뿐만 아니라 세포 속에서도 수백개에 이르는 분자가 복잡한 상호작용을 하고 있으며 조직과 기관을 구성하는 세포는 37억-60억개에 달하는 등 정보량이 일반적인 컴퓨터 처리능력으로는 해결하기 어려울 정도로 방대하기 때문이다.
이에 따라 앞으로는 AI, 기계학습을 도입하는 움직임이 확대될 것으로 예상되고 있다.
농업·식품, 게놈 편집기술 규제 논란
농업은 GM에 이어 게놈 편집기술 등 NBT(New Breeding Techniques)가 개발됨에 따라 품종 개량을 위한 기술 플랫폼의 선택지가 증가하고 있으며 종자 분야는 구조재편이 가속화되고 있다.
글로벌 종자 시장은 오래전부터 글로벌기업이 6강으로 자리 잡고 있었으나 최근 켐차이나(ChemChina) 산하의 신젠타(Syngenta), 2018년 여름 몬산토(Monsanto) 인수를 완료한 바이엘(Bayer), DowDuPont(Corteva Agriscience), 바스프(BASF) 4강으로 변화했다.
종자 생산기업들은 국제경쟁력이 강화됨에 따라 고품질 품종 개발속도 향상, 종합적인 농업 솔루션의 신속한 제공이 가능할 것으로 기대하고 있어 이노베이션을 창출할 수 있는 체제 구축에 박차를 가하고 있다.
농업생명공학 응용을 위한 국제서비스(ISAAA)에 따르면, 유전자 재조합 농산물인 GMO는 2017년 세계 재배면적이 1억8980만ha로 전년대비 3% 증가했다.
24개국이 상업재배를 실시하고 있으며 콩, 옥수수, 목화, 유채가 주류를 이루고 있는 가운데 RNA 간섭에 따른 변색 방지 작물, 고엽병에 대한 저항성을 부여한 감자, 갈변하지 않는 사과, Bt 가지, 베타카로틴(β-Carotene)이 함유된 핑크파인애플 등 새로운 작물이 잇따라 등장하고 있다.
이에 따라 GMO 식품표시에 대한 관심이 높아지고 있다.
일본은 소비자청이 유전자 재조합이 아님을 임의로 표시하는 조건을 정리해 소비자위원회가 심의를 진행하고 있으며 미국은 2018년 5월 농무부(USDA)가 제안한 표시규칙을 토대로 법률 제정을 준비하고 있다.
작물 이외에 곤충에 대한 연구개발도 진행되고 있다.
일본에서는 2017년부터 녹색형광단백질(GFP)을 함유한 견사를 생산하는 누에나방 사육이 가능해졌으며 2018년부터는 고염색성 견사를 생산하는 누에나방 사육실험이 진행되고 있다.
게놈 편집 분야에서는 일본기업의 활약이 두드러지고 있다.
농업·식품산업기술종합연구기구(NARO)는 수율 향상을 위한 개변 벼 재배실험을 진행하고 있으며 가네카(Kaneka)와 공동으로 밀 품종개량 프로세스를 대폭 간소화해 단기간에 품질개량이 가능한 in planta 게놈 편집기술을 개발했다.
싹에 유전자와 효소를 직접 도입하는 iPB 공법에 게놈 편집기술을 조합한 육종기술로 범용성이 매우 높은 것으로 파악되고 있다.
게놈 편집 연구거점을 보유한 히로시마대학은 도쿄의과치과대학과 함께 CRISPR/Cas9을 개량해 게놈 편집확률을 높이는 LoAD 시스템을 개발했다.
세포에 대한 유전자 삽입효율이 약 2배에 달해 3개의 다른 게놈영역에 대한 동시 유전자 삽입이 가능한 것으로 알려졌다.
동물과 관련해서는 산업기술종합연구소(AIST)와 NARO가 난백에 유용단백질이 대량 함유된 달걀을 낳는 유전자 개변 닭을 생산하는 기술을 개발했다.
CRISPR/Cas9을 닭에 적용해 유용단백질을 삽입(Knock-in)했으며 바이오의약품 원료, 재생의료 연구용 시약 등을 포함한 달걀 대량생산을 목표로 연구를 계속하고 있다.
도쿄대학을 비롯해 Toyota Central R&D Labs, 도요타자동차(Toyota Motor), RIKEN이 구성한 공동그룹 및 오사카대학의 연구그룹도 신규 게놈 편집기술을 이용해 혁신적인 성과를 거두고 있다.
게놈 편집기술 규제 놓고 마찰
게놈 편집기술은 세계적으로 규제를 둘러싼 논란이 잇따르고 있다.
유럽 사법재판소는 2018년 7월25일 게놈 편집기술을 이용해 개발한 작물을 GMO와 동일하게 규제해야 한다는 판결을 내렸다.
소송은 프랑스 농업생산자단체가 게놈 편집을 비롯한 NBT에 대해 사법적 판단을 요구하면서 제기된 것으로, 유럽 사법재판소는 “돌연변이 유발기술·방법이 생물의 유전형질을 자연적이지 않은 형태로 변화시키는 한 유럽연합(EU) 규제에서 정의하는 GMO에 해당한다”고 밝혔다.
이에 따라 외부 유전자를 도입하지 않는 게놈 편집 작물도 GMO 규제대상에 포함시켜 건강 및 환경에 미치는 영향 평가 및 트레이서빌리티(Traceability), 표시, 모니터링을 의무화하고 있으며 앞으로 세계 각국의 규제에 영향을 미칠 가능성이 높아지고 있다.
반면, 미국 USDR은 2018년 CRISPR 등 외부 유전자를 도입하지 않는 게놈 편집기술로 개발한 작물을 규제하지 않겠다는 의사를 표명했다.
미국에서는 이미 10건 이상의 게놈 편집 품종이 등장해 상업재배를 시작한 가운데 USDR의 발표에 따라 종자 사업이 더욱 활성화될 것으로 예상되고 있다.
일본에서는 2018년 여름 환경성이 동물 및 식물 게놈 편집기술에 대한 규제안을 마련했고 외부 유전자를 도입하고자 하는 위치에 집어넣은 경우는 규제하나 외부 유전자를 도입했더라도 해당 유전자와 산물이 최종적으로 사라지는 경우는 규제하지 않는다는 내용을 담고 있다.
일본 후생노동성도 9월부터 게놈 편집기술을 사용한 식품에 대한 규제방안을 검토하고 있다.
바이오플래스틱, 보급 확대로 순환경제 견인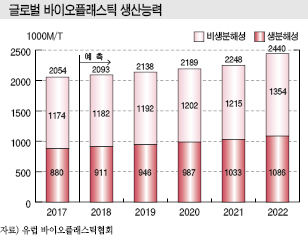
바이오플래스틱은 지구온난화, 화석자원 고갈, 미세 플래스틱을 포함한 폐기물 문제에 유효한 솔루션을 제공함과 동시에 순환경제에 기여하는 소재로 세계적인 보급에 대한 기대가 높아지고 있다.
특히, 생분해성 플래스틱은 해양 플래스틱 쓰레기 문제에 대응할 수 있는 소재로 크게 주목받고 있다.
그러나 보급을 확대하기 위해서는 코스트 다운을 포함해 경제성을 향상시키는 등 다양한 과제를 해결함과 동시에 주변환경을 정비해야 할 것이 요구되고 있다.
바이오플래스틱은 식물원료를 사용한 바이오매스 플래스틱, 미생물 작용에 따라 최종적으로 물과 이산화탄소(CO2)로 분해되는 생분해성 플래스틱으로 분류된다.
유럽 바이오플래스틱협회에 따르면, 글로벌 바이오플래스틱 생산능력은 PLA(Polylactic Acid), PHA(Polyhydroxy-alkanoate)를 중심으로 2017년 205만톤에서 2022년 244만톤으로 늘어날 것으로 예상되고 있다.
최근에는 코카콜라(Coca-cola)가 바이오 PET(Polyethylene Terephthalate) 병을 사용하는 등 사회적 책임(CSR)을 중시하는 수요기업을 중심으로 바이오플래스틱 채용을 확대하고 있다.
일본에서는 도요보(Toyobo)와 Mitsui물산이 벤처기업 신비나(Synvina)와 함께 상업화를 추진하고 있는 100% 바이오 PEF(Polyethylene Furanoate)가 기능성 측면에서 주목받고 있다.
가스배리어성, 투명성 등 다양한 특성이 PET에 비해 뛰어난 것으로 알려졌다.
관련기업 및 학계에서도 움직임을 본격화하고 있다.
일본 화학 관련단체들은 미세 플래스틱의 해양오염 문제가 심각해짐에 따라 해양 플래스틱 문제 대응협의회(JaIME)를 설립했다.
가네카는 100% 식물유래 생분해성 수지 PHBH를 개발해 2017년 유럽의 국제인증기관으로부터 바다 속에서 생분해된다는 인증을 취득한데 이어 생산설비를 대형화함과 동시에 2만톤 상업플랜트를 건설하는 방안을 검토하고 있다.
생분해성 플래스틱은 Mitsubishi Chemical(MCH)이 PBS(Polybutylene Succinate)의 100% 바이오화를 추진하고 있으며 신규 바이오 폴리에스터(Polyester) 양산을 계획하고 있다.
지방자치단체도 채용을 확대하고 있다.
교토(Kyoto) 지방정부는 2017년 교토의정서 탄생 20주년을 맞아 바이오 PE(Polyethylene)를 활용한 가정용 유료 쓰레기봉투를 본격 생산하기로 결정했다.
바이오의약품, 개발·제조체제 구축이 관건
일본기업들은 항체의약품을 비롯한 바이오의약품 분야에서 해외기업에 비해 크게 뒤처지는 것으로 평가되고 있다.
대규모 선행투자가 부족할 뿐만 아니라 일본에서 개발된 신규 항체의약품이 거의 없기 때문이다.
Chugai Pharmaceutical, Kyowa Hakko Kirin만이 신약 개발부터 제제 개발, 상업생산까지를 단독으로 수행할 수 있는 기반을 구축하고 있으며 이밖에는 해외기업을 인수하거나 해외제품을 도입해 바이오의약품 시장에 진입하는 곳이 대부분이어서 인재 및 기술을 육성하지 못하고 있다.
바이오의약품 위탁생산(CMO), 소재·장치도 일본에서 개발·생산되는 의약품이 없어 경험을 축적하지 못하고 있다.
이에 따라 제약 관련 33사는 대학 등과 협력해 항체의약품 제조기반을 개발하는 차세대 바이오의약품 제조기술연구조합(MAB)을 설립했다.
세포주 구축부터 원제정제, 품질평가에 이르기까지 필요한 기술, 설비 등을 자체적으로 개발해 해외에 의존하지 않는 제조 플랫폼을 구축할 방침 아래 실제 임상시험 약품을 위탁 제조하기 위한 실증작업에 들어간 것으로 알려졌다.
2018년부터 실용화 사례가 없는 연속생산기술에 도전하고 있으며 3년 이내에 50리터 탱크를 이용한 60일 연속생산에 성공하겠다는 목표를 세우고 있다.
인재육성에도 힘을 기울이고 있다.
MAB의 활동거점이 있는 고베대학 통합연구센터에 바이오의약품 제조, 개발, 분석에 관한 교육 프로그램을 제공하는 사단법인 바이오로직스연구·트레이닝센터(BCRET)를 2017년 설립했다.
항체의약품을 개발한 경험이 있는 제약기업의 기술자 및 연구자를 강사로 초청해 바이오 제약 및 관련기업, 당국 담당자를 대상으로 연구기회를 제공하고 있으며 MAB의 파일럿 설비를 소규모로 재현한 실험실을 마련해 세포주 구축, 원제 정제에 대한 기초기술을 학습하는 실습코스도 운영하고 있다.
아시아 바이오 시장을 선도하기 위해 각국의 규제당국 담당자를 대상으로 연구 및 실습 기회를 제공하는 방안도 고려하고 있는 것으로 알려졌다.
재생의료, iPS세포 임상응용 잇달아…
재생의료 분야에서는 iPS세포(유도만능줄기세포)가 실용화를 위한 임상연구 단계에 들어섰으며 간엽계 줄기세포, CAR (Chimeric Antigen Receptor)-T 세포 치료제에 대한 임상시험 및 신청이 잇따르고 있다.
일본에서는 iPS세포를 이용한 재생의료 분야에서 RIKEN과 벤처기업 HEALIOS가 노년성 황반변성 임상연구를 가장 먼저 진행해 재생의료제품 승인에 필요한 임상시험을 준비하고 있으며 교토대학 iPS세포연구소(CiRA)는 2018년 8월부터 파킨슨병에 대한 임상시험을 시작했다.
Sumitomo Dainippon Pharma는 2022년 출시를 목표로 노년성 황반변성과 파킨슨병 치료제 상업화를 추진하고 있는 가운데 2018년 3월 오사카(Osaka) 소재 재생·세포의약품 제조설비를 완공해 임상시험 및 상업생산을 준비하기 시작했다.
파킨슨병 임상시험에는 제네릭(Generic) 생산기업 Towa Pharmaceutical, Nihon Medi-Physics가 협력해 일본기업의 기술력을 결집하고 있다.
오사카대학은 5월부터 iPS세포를 이용해 심근시트를 만들어 중증 허혈성 심근증 환자에게 이식하는 임상연구를 진행하고 있다.
벤처기업 CUORiPS가 기술 사업화를 목표로 하고 있으며 2017년 Daiichi Sankyo가 글로벌 판매권을 취득했다.
일본 후생노동생은 9월 자가 iPS세포 유래 혈소판을 이용하는 재생불량성 빈혈의 임상연구를 승인했다.
벤처기업 Megakaryon은 해당기술을 발전시켜 환재 유래가 아닌 타가 유래 iPS세포의 혈소판 제제를 이용한 수혈의료를 개발할 방침이다.
일본·미국에서 진행하는 임상시험 및 양산설비 건설을 위한 증자에는 Otsuka Pharmaceutical, Sysmex가 참여한다.
간엽계 줄기세포를 채용한 재생의료제품 개발도 활발하게 이루어지고 있다.
NIPRO는 삿포로의과대학과 공동으로 척수손상 치료에 이용하는 자가골수 간엽계 줄기세포를 개발해 6월 후생노동성에 제조·판매에 대한 승인신청서를 제출했다.
뇌경색 치료에 대해서는 벤처기업 SanBio와 HEALIOS에 이어 MCH 산하 생명과학연구소가 Muse세포를 이용한 탐색적 임상시험을 시작했다. 이미 시험을 진행하고 있는 급성 심근경색을 잇는 2번째 적응증이다.
CAR-T, 혈액암 면역요법으로 부상
CAR-T 치료제도 재생의료제품으로 주목받고 있다.
CAR-T 치료제는 환자의 혈액에서 T세포를 추출한 후 바이러스 등을 이용해 암세포에 특이적으로 반응하는 키메라 항원 수용체 DNA를 T세포에 주입하고 증식시켜 다시 환자의 몸속에 넣어주는 방식으로 혈액암에 대한 새로운 면역요법으로 미국과 유럽에서 승인이 잇따르고 있다.
미국에서 재발·난치성 급성림프성 백혈병에 대한 임상시험을 실시한 결과 약 90%의 환자가 증상 완화를 경험하는 등 매우 우수한 치료효과가 확인된 것으로 알려졌다.
일본에서는 Novartis Pharma가 B세포성 급성림프구성 백혈병에 대한 CAR-T 치료제 Kymriah를 개발해 4월 후생노동성에 승인을 신청했다.
이밖에 Takara Bio, Daiichi Sankyo, 셀젠(Celgene)이 임상시험에 돌입했으며 후지필름(Fuji Film)과 Takeda Pharmaceutical 등도 개발을 추진하고 있다.
Novartis의 Kymriah 등은 환자 유래 세포를 이용하고 있으나 타가 유래 세포나 기존기술에 비해 특이적으로 가공속도가 빠르고 가격이 낮은 크리스퍼(CRISPR/Cas9)를 활용한 차세대 CAR-T 치료제에 대한 연구개발도 이루어지고 있다.
Ono Pharmaceutical은 9월 iPS세포 유래의 타가 CAR-T 치료제 연구를 목적으로 미국기업과 제휴계약을 체결했다.
일본, 노벨생리의학상 수상에도 “찜찜…”
일본은 2018년 혼조 다스쿠 교토대학 특별교수가 노벨생리의학상을 수상함으로써 생명과학 분야의 기초연구능력이 높은 평가를 받았다.
혼조 교수는 인간의 면역체계에 제동을 거는 분자 PD-1 단백질을 발견해 세계 최초의 항PD-1 항체인 옵디보(Opdivo) 개발에 크게 기여했다.
옵디보는 암세포 자체를 직접 공격하는 기존 치료제와 달리 환자의 면역체계를 강화해 암세포를 소멸시키는 새로운 접근의 치료방법으로 면역관문억제제, 면역항암요법으로 불리고 있다.
T세포는 암세포 등 위험물질이 발견되면 공격해 제거하는 면역체계를 담당한다.
혼조 교수는 암세포에 존재하는 PD-L1 단백질이 T세포의 PD-1과 결합하면 T세포가 암세포를 인식할 수 없게 된다는 사실을 발견했다.
이후 Ono Pharmaceutical이 옵디보를 상품화한데 이어 항PD-1/PD-L1 항체 개발이 잇달아 면역관문억제제를 중심으로 면역항암요법에 대한 개발경쟁이 가속화되고 있다.
옵디보는 오랜만에 일본기업이 개발한 대형 바이오의약품이나 일본산 항체로 볼 수 없다는 의견도 제기되고 있다.
Ono Pharmaceutical은 혼조 교수가 항PD-1 항체의 실용화를 목표로 공동연구를 제안한 당시 신약 창제에 대한 경험이 적고 항암제 개발 노하우도 없다는 이유로 거절한 바 있으며 이후 다른 제약기업에게 도움을 요청했으나 응하는 곳이 없었다.
결국 다른 면역관문억제제를 연구하던 미국 Medarex를 파트너로 선정해 개발을 시작했으며 Bristol-Myers Squibb (BMS)이 Medarex를 인수하면서 옵디보를 글로벌 시장에 정착시키는데 성공했다.
일본은 오래전부터 학계의 연구성과를 제약기업이 주목하지 않는다는 점이 문제시되고 있다.
혼조 교수는 노벨상 수상 기자회견에서 “일본 학계에도 우수한 자원이 많으나 최근 일본기업들은 일본이 아닌 외국에서 자원을 확보하려는 경향이 있다”며 “안목이 전혀 없다”고 강하게 비판했다.